貧血と白血球減少
問題37
80歳の男性。糖尿病、高血圧症、脂質異常症、慢性胃炎などで近医通院中であった。初診の9か月前の健診では白血球4400/μL、赤血球414万/μL、Hb 12.7 g/dL、Hct 38.2%、血小板17.6万/μLであったが、定期健診での血液検査で貧血と白血球減少の傾向が出てきたため照会となった。特に自覚症状はない。
現症:眼瞼結膜軽度貧血あり。肝脾触知せず。
検査所見:血液所見:白血球2900/μL(好中球45.5%、リンパ球48.0%、単球3.0%、好酸球2.5%、好塩基球1.0%)、赤血球409万/μL、Hb 12.5 g/dL、Hct 37.6%、血小板17.9万/μL、血液生化学所見:LDH 146 U/L、T-Bil 0.5 mg/dL、Fe 103 μg/dL、Vit B12 1284 pg/mL、葉酸 10.2 ng/mL、免疫生化学所見:ANA<40倍
骨髄穿刺検査所見
正形成骨髄。好中球系:前骨髄球0.8%、骨髄球5.2%、後骨髄球3.6%、桿状白血球5.2%、分葉核白血球14%、好酸球系:後骨髄球0.8%、分葉核白血球2.8%、単球0.8%、リンパ球7.2%、形質細胞3.2%。赤血球系:前赤芽球0.8%、好塩基球1.2%、多染赤芽球44.4%。芽球(主に骨髄芽球)を8.8%認めた。
顆粒球には偽Pelger核異常を有する好中球、過分葉好中球が認められ、巨核球には微小巨核球が散見された。赤芽球には環状鉄芽球を少数(0.28%)認めた。
骨髄所見を示す。
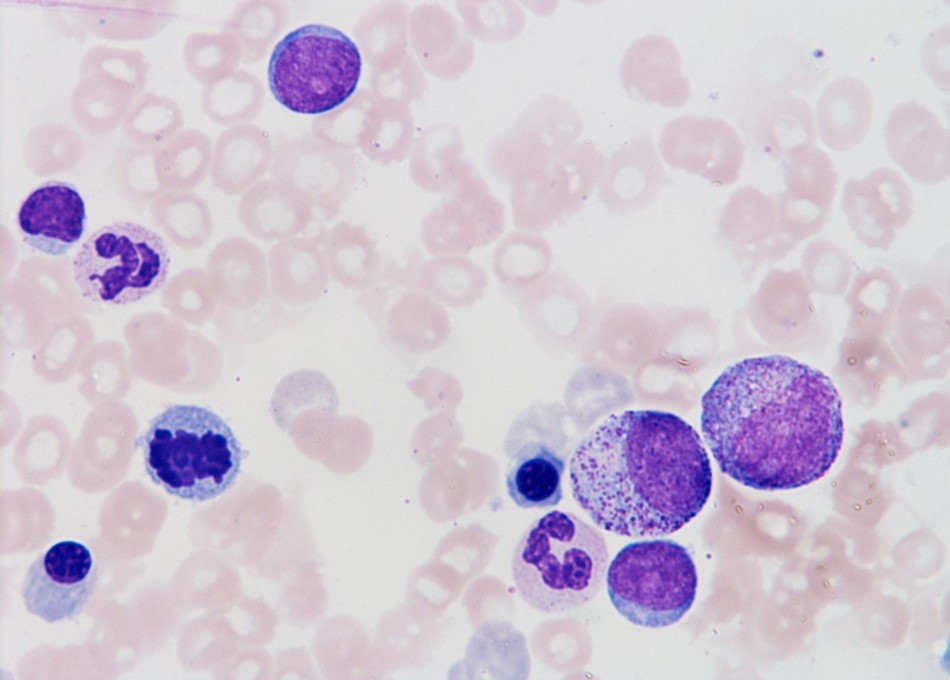
染色体異常は認めなかった。
適切な方針はどれか1つ選べ。
(a)レナリドミド投与
(b)メチルプレドニゾロンパルス療法
(c)鉄剤投与
(d)DNAメチル化阻害薬アザシチジン投与
(e)経過観察
解説(オリジナルは『Dr. Tomの内科症例検討道場』にはないが院内で行った内科症例検討道場で症例299として扱ったもの)
まず初診時の所見であるが、9か月前に比べて明らかに白血球が減少してきていること、貧血は進行していないが以前からみられていて、MCV=36.2÷377×1000=96.0、MCH=12.4÷377×1000=32.8であるため、正球性正色素性貧血であること、血小板数も正常域ではあるが低めで推移していることなどがうかがえるデータである。このように高齢の男性で、白血球、赤血球、血小板の3系統のうち2系統以上におよぶ血球減少がみられ、貧血は正球性ないし大球性貧血を認めた場合、疑いたい疾患は骨髄異形成症候群(myelodysplastic syndrome;MDS)である。骨髄所見を確認したところ、骨髄は顆粒球には偽Pelger核異常を有する好中球や過分葉好中球が認められ、巨核球には微小巨核球が散見され、赤芽球には環状鉄芽球を少数(0.28%)認めた。3系統に異型性が認められ芽球が8.8%(主に骨髄芽球)みられたためMDSと確定診断された(図1)。環状鉄芽球が0.28%と少なく、WHO分類ではRAEB-1(refractory anemia with excess of blasts -1)の範疇に入ると考えられた(表1)。 なお、一般的にMDSの段階では芽球はまだ十分な自立性増殖ができないためアポトーシスに陥り無効造血となって、芽球の頻度も少ない状態であるが、遺伝子変異が進んで自立性増殖が可能となると、芽球の頻度も増えて急性骨髄性白血病に移行する症例がある(白血病化)。高齢者の貧血をみた場合に重要な鑑別疾患として、また急性骨髄性白血病のひとつの前段階の病態として念頭におきたい。
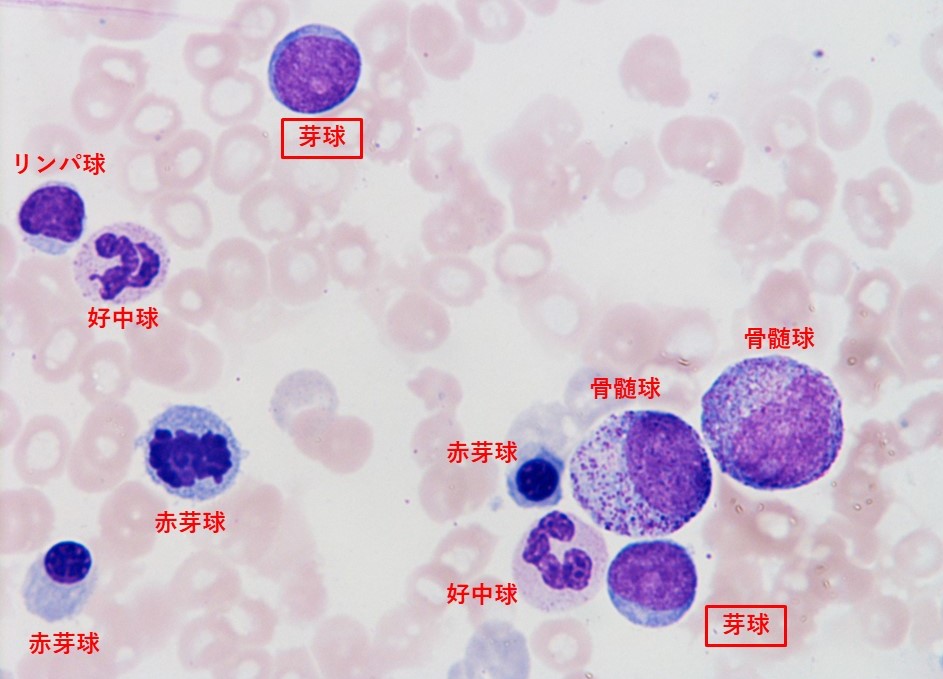
図1:骨髄所見。このスライスには提示できていないが顆粒球、巨核球、赤芽球の3系統に異型性があり、図のような芽球を8.8%認めた。

表1:MDSのWHO分類。RA;refractory anemia, RN; refractory neutropenia, RT; refractory thrombocytopenia, RARS; refractory anemia with ringed sideroblasts, REAB; refractory anemia with excess of blasts, MDS-U; myelodysplastic syndrome- unclassified, RCUD; refractory cytopenia with unilineage dysplasia.
病型が決まれば次に予後の予測を立てる。新しいスコアリングシステムも提唱されているが、以前から国際予後予測スコアリングシステム(IPSS;international prognostic scoring system)というスコアを用いてその予後を3つのリスク群に分類して予測する。
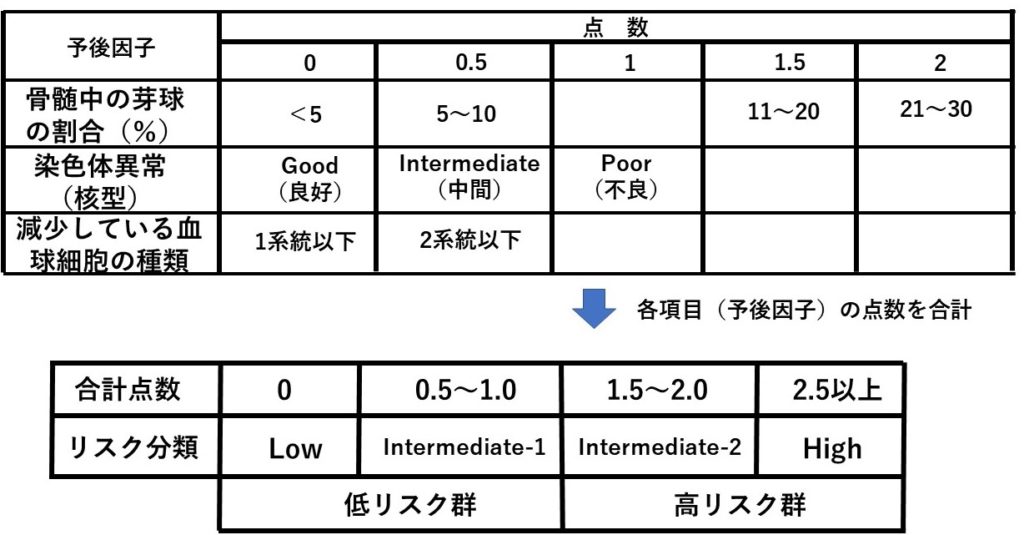
表2:国際予後予測スコアリングシステム(International prognostic scoring system; IPSS)。ここで染色体異常の項目で、良好の場合は、正常、-Y、del(5q)、del(20q)、不良の場合は複雑核型(3種類以上)、7番染色体異常、中間の場合は良好でも不良でもないもの。血球減少の基準はHb<10 g/dL、好中球<1800 /μL、血小板<10万/μL。
最後にこのリスク分類、症状の有無、年齢、全身状態、などを考慮して、以下のアルゴリズムに沿って治療方針が立てられる。
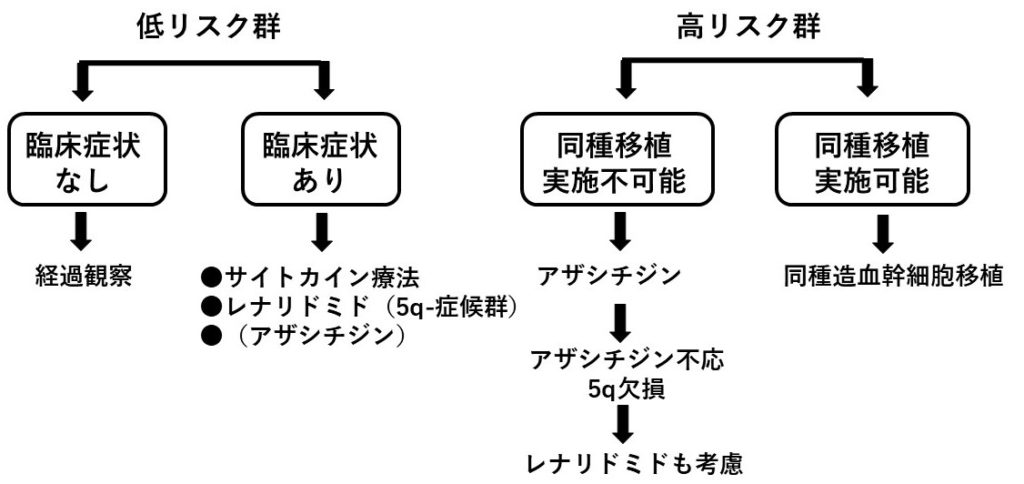
図2:MDSに対する治療方針アルゴリズム。リスク分類と臨床症状の有無に加えて、特に高リスク群では年齢、全身状態を考慮して同種移植が実施可能かどうかも判断したうえで治療方針を決定する。
今回の症例では、IPSSに基づくと、骨髄中の芽球が5~10%で0.5点、染色体異常は検出されず0点、好中球<1800/μLで1系統なので0点で合計0.5点となりIntermediate-1で低リスク群と予測され、特に臨床症状もなく経過観察が妥当である。
図2で記載されている内容の補足
●5q-は、5番染色体長腕(5q)の一部が切断されてその断片が欠失(deletion)した染色体異常であるが、この異常を単独異常として有するMDSを5q-症候群として独立した症候群として分類されている。これは中年~高齢女性に多く、赤血球系統のみの異常として大球性貧血を呈し、血小板は維持されて、芽球出現がほとんどなく、比較的予後良好なことが多いなど、ほかとはちがった特徴を呈するからである。
●レナリドミド(レブラミド®)はサリドマイドの神経毒性を減弱させたサリドマイド類似薬。MDSに有効性を示す。5q-症候群に有効であることが判明し、第1選択薬となっている。
●アザシチジン(ビダーザ®)は核酸化合物シチジンの誘導体。DNAに取り込まれてメチル化抑制(脱メチル化)し、癌抑制遺伝子の発現を回復させる。またシトシンの代わりに腫瘍細胞(本疾患では芽球)のRNAにも取り込まれ蛋白合成阻害を起こす。白血病化の抑制、生存期間延長効果、QOL改善効果などが期待され、同種造血幹細胞移植が不可能な高リスク患者の第1選択薬となっている。
表2の補足
●本疾患の予後因子は、骨髄中の芽球の割合、染色体異常の数、減少している血球細胞の種類(何系統あるか)である。
解答:(e)
実際の症例では
血小板、白血球の低下がわずかずつ進み、6年後の骨髄穿刺検査を再検したところ、芽球が増加していた。造血幹細胞移植は困難であったためアザシチジンが導入された。

