健診で肝機能障害を指摘されて
問題75
52歳の女性。市民健診で肝機能異常を指摘された。近医で再検査を受けたが同様の異常が認められるため当院紹介された。特に常用薬やサプリメントなどはない。
生活歴:機会飲酒。喫煙歴なし。
現症:身長 150.0 cm、体重 48.0 kg。血圧 128/70 mmHg、脈拍 85/分、整。体温 36.5℃。皮膚可視粘膜に貧血・黄疸なし。腹部は平坦、軟で肝臓を触知せず。四肢に浮腫なし。
検査所見:血液所見:白血球6000/μL、赤血球439万/μL、Hb 14.4 g/dL、Hct 43.4%、血小板18.7万/μL。血液生化学所見:Alb 4.4 g/dL、IgG 1969 mg/dL(基準870~1700)、IgM 350 mg/dL(基準46~260)、AST 40 U/L、ALT 38 U/L、ALP 506 U/L、γ-GTP 295 U/L。免疫血清学所見:HBs抗原陰性、HCV抗体陰性、ANA陰性、抗ミトコンドリア抗体陽性。
この疾患について正しいものを1つ選べ。
(a)慢性非化膿性破壊性胆管炎を認めることが多い。
(b)総胆管病変が胆管障害の主病変である。
(c)第1選択薬は副腎皮質ステロイドである。
(d)常染色体優性遺伝である。
(e)若い女性に多い。
解説(オリジナルは『Dr. Tomの内科症例検討道場』第3版の症例160)
オリジナルは少し非典型的だったため、問題用に修正して提示している。健診で肝機能異常を指摘されて精査のため紹介された患者である。肝障害の特徴としては、トランスアミナーゼがAST 40 U/l、ALT 38 U/lとほぼ正常であり、ALP 506 U/l、γ-GTP 295 U/lと明らかに胆道系酵素が優位に上昇しており、肝細胞障害型ではなく胆汁うっ滞型の肝障害パターンである。さらに抗ミトコンドリア抗体が陽性であれば原発性胆汁性胆管炎(primary biliary cholangitis;PBC)と診断できる。
PBCは、自己免疫的機序により主として小葉間胆管が破壊され消失することにより慢性進行性に胆汁うっ滞を呈する疾患である。胆汁うっ滞に伴い肝実質細胞の破壊と線維化が進行すれば最終的には肝硬変から肝不全を呈する。1:7で女性に多く、多くは50~60歳台で発症する。無症候性PBCと症候性PBCとに分けられるが、初診時に症状を呈する場合は胆汁うっ滞による皮膚掻痒感が多い。胆汁酸分泌の低下もみられ、これにより脂溶性ビタミンの吸収障害がおこり、中年以降で閉経後の女性が通院する場合が多いので、骨粗鬆症についても対策が必要である。PBCは組織学的には、例えばScheuer分類ではステージ1:florid duct lesion(胆管上皮の慢性非化膿性破壊性胆管炎chronic nonsuppurative destructive cholangitis:CNSDC、つまり感染などによる化膿性病変ではなくて胆管を破壊する胆管炎がみられる時期)、ステージ2:ductular proliferation(細胆管増生がみられCNSDCも顕著にみられる時期)、ステージ3:scarring(線維性隔壁が形成され、胆管消失も見られてきて、CNSDCは目立たなくなる時期)、ステージ4:nodular cirrhosis(文字通り肝硬変期)の4期に分類される。また、通常のウイルス性肝炎に比べて、組織学的に肝硬変に至っていない時期から脾腫など門脈圧亢進所見が出現することが知られている。治療は、ウルソデオキシコール酸(ウルソ®)600 mg/日、無効の場合は900 mg/日に増量、これでも無効であれば、ベザフィブラート(ベザトールSR®)400 mg/日の投与を考慮する。疾患自体が骨粗鬆症の合併を起こしやすいうえに、プレドニゾロンはさらにこれを助長する恐れがあり、通常は投与されない。また皮膚掻痒症に対してはコレスチラミド、抗ヒスタミン剤、骨粗鬆症については、ビスフォスフォネート製剤などを考慮する。
解答:(a)
実際の症例では
実際の症例は62歳の女性。抗ミトコンドリア抗体<20倍、抗ミトコンドリアM2抗体<2.0 Indexといずれも陰性で、抗核抗体320倍と高力価陽性、その染色パターンはセントロメアタイプだった。通常、抗核抗体が高力価陽性で肝障害といえば自己免疫性肝炎(autoimmune hepatitis;AIH)を考えたいところだが、PBCの亜型としてセントロメアに染色パターンを呈する抗核抗体、またはセントロメアに対する自己抗体である抗セントロメア抗体が陽性となるものがある。ということで、今回のオリジナルの症例は、血液生化学検査からは胆道系酵素が優位の肝機能障害であり、基本的にAIHではおかしい。抗核抗体陽性だが、染色パターンはどうか?と考えてほしいと思って症例検討会に採りあげた症例であった。
今回の症例については経皮的肝生検を施行している。採取された肝組織内には複数の門脈域が観察できるが、ほとんど正常のものから中等度から高度の慢性炎症を伴い慢性非化膿性破壊性胆管炎(chronic non-suppurative destructive cholangitis;CNSDC)の像を示すものまで混在している(図1)。まずこのように門脈域によってかなり所見がちがっているのはAIHやPBCなどの自己免疫性肝疾患の特徴である。最も強い炎症細胞浸潤を伴う門脈域には類上皮肉芽腫が形成されている(図1-d、3, 4)。CNSDCとは、小葉間胆管(生検組織の中では比較的大きく太めの胆管)の周囲に高度のリンパ球浸潤があり(化膿性の場合は好中球でありここが化膿性胆管炎との違い)、胆管上皮基底膜の破壊、胆管上皮の重層化、胆管上皮内へのリンパ球浸潤など胆管上皮の障害像が認められる(図2)。一方、肉芽腫とは、病巣中心部に組織球からなる結節があって、その周囲を器質化組織である肉芽組織がとり囲む組織構築を有する結節である。組織球は、肝内では活性化されてしばしば細長い上皮に類似した類上皮細胞として認められるのでこのような肉芽腫を類上皮肉芽腫という。今回の症例で、図1-dの部分を拡大したところには、類上皮細胞、リンパ球、形質細胞、好酸球など多数集簇していて炎症の活動性も高く、その周囲あるいは近傍で無構造の器質化した肉芽組織が認められている(図3)。これが類上皮肉芽腫である。類上皮細胞は、リンパ球、形質細胞、好酸球などで処理することができない抗原を貪食することによって隔離する生体の反応と理解されており、CNSDCとともにPBCで診断的価値が高いとされている。一部の拡大した門脈域には胆管の減少と線維組織の増加が認められる。しかし線維組織による架橋形成はほとんどの部分で認められない(図1)。また一部の組織では比較的広い範囲に線維性拡大した門脈域がみられるが、好中球やリンパ球など炎症細胞の浸潤は弱く、炎症の活動性は低下している。本来はこの程度の門脈域には動脈の近傍に、もう少し複数の胆管の断面が観察できてもよさそうだが、実際は、脱落した胆管上皮をもつ胆管の1断面しか認められない(図4、黄矢印)。また小葉内にはspotty necrosisやinterface hepatitisなど壊死性変化は稀にしか認められず、PBC主体の変化と考えられる。Scheuerの分類では1~2程度といえる。
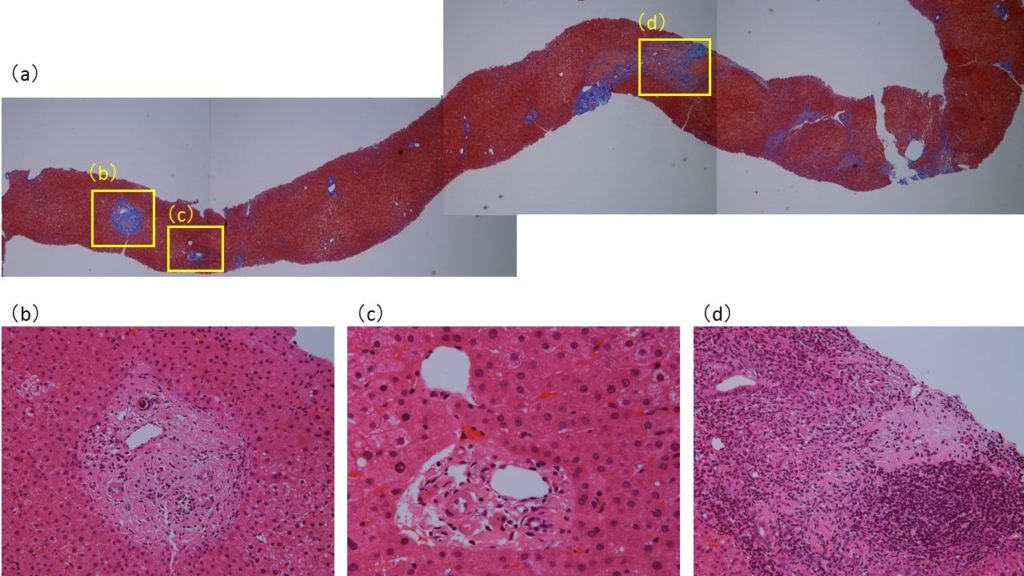
図1:肝組織所見。(a):EVG染色。(b)~(d):HE染色。(a)門脈域の線維性拡大の程度はさまざまであるがほとんどの領域で線維性隔壁の形成には至っていない。
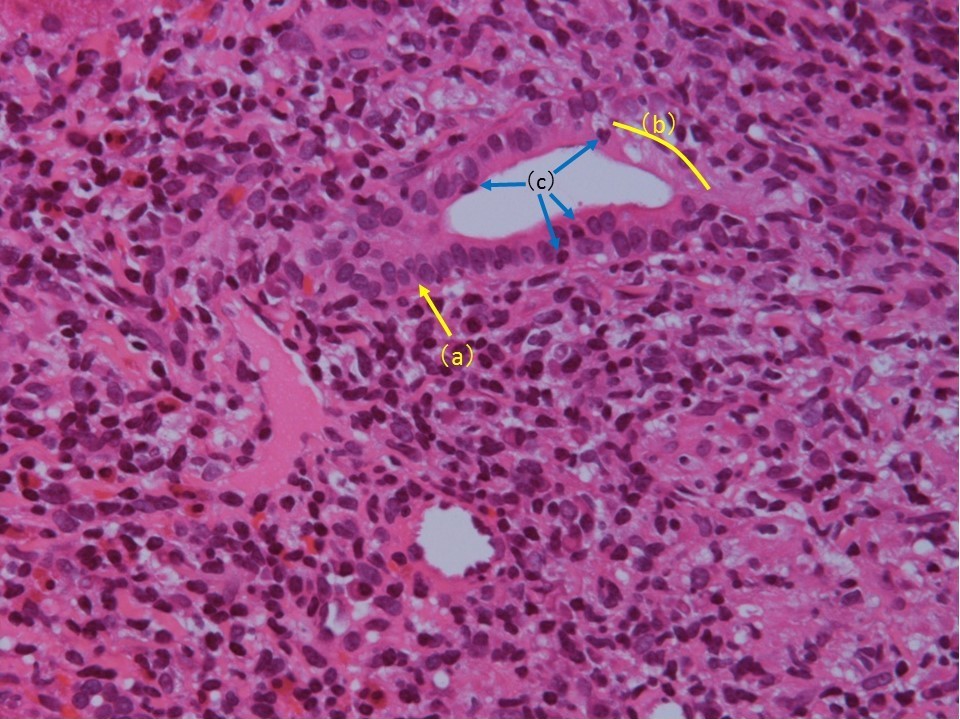
図2:類上皮細胞、リンパ球、形質細胞、好酸球など多数集簇していて炎症の活動性も高く、比較的太い小葉間胆管と思われる胆管には上皮の重層化(a)、上皮基底膜の破壊(b)、上皮内へのリンパ球浸潤(c)など障害像が認められ、慢性非化膿性破壊性胆管炎(CNSDC)の所見である。
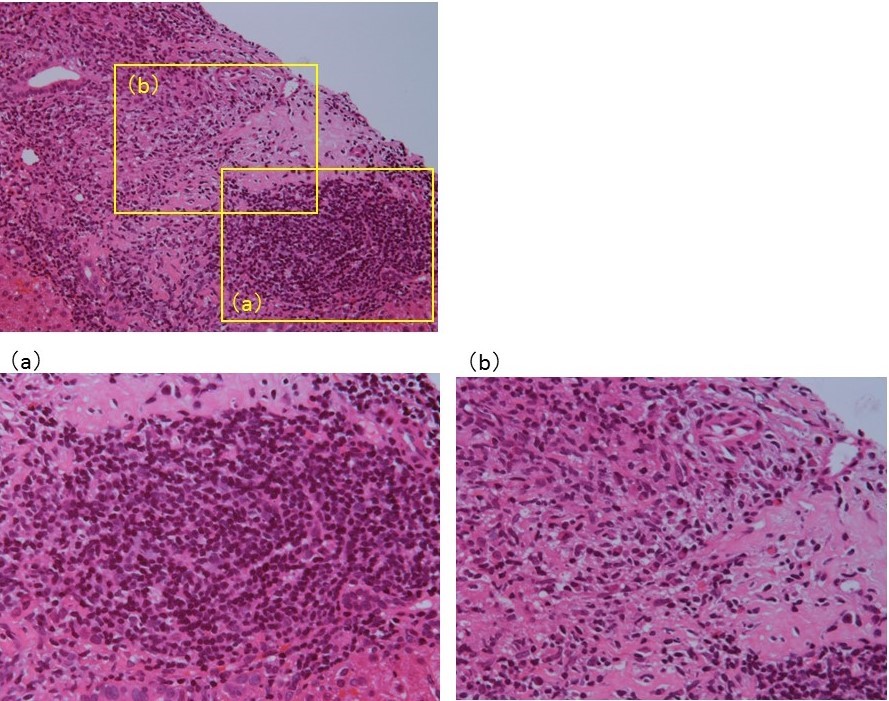
図3:類上皮細胞、リンパ球、形質細胞、好酸球など多数集簇していて炎症の活動性も高い領域(a)と、それに接する無構造の器質化した肉芽組織(b、右半分あたり)が認められ、類上皮肉芽腫である。
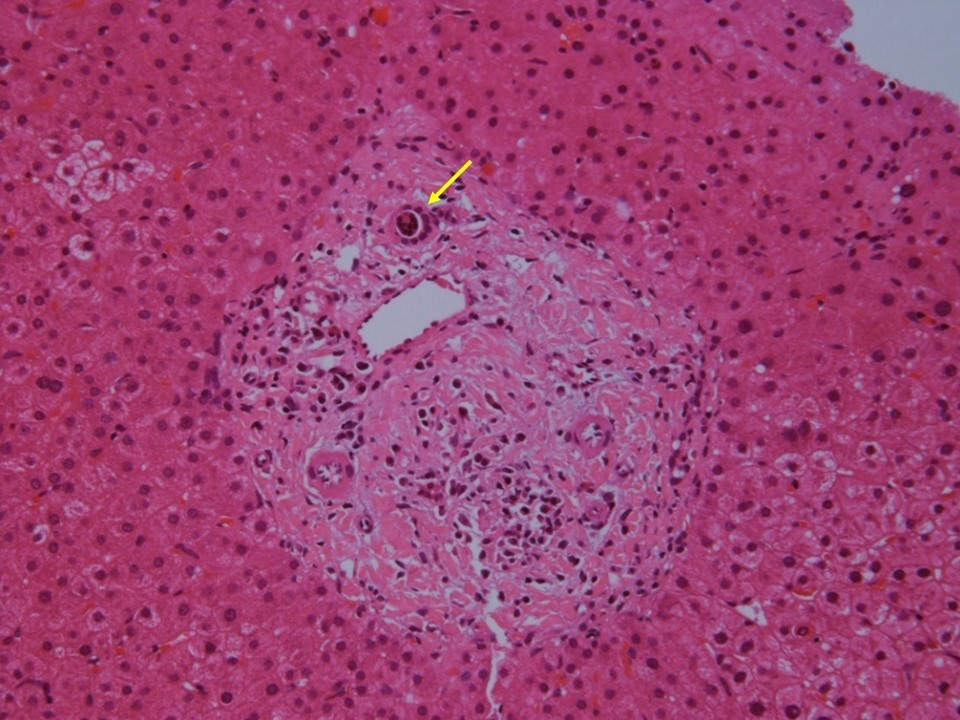
図4:比較的広い範囲に線維性拡大した門脈域がみられるが、炎症細胞の浸潤は弱く、炎症の活動性は低下している。本来この程度の門脈域には動脈の近傍に、複数の胆管の断面が認められるはずであるが、脱落した胆管上皮をもつ胆管の1断面しか認められない(黄矢印)。
抗ミトコンドリア抗体陰性で抗核抗体が高い今回のような症例では、もしウルソデオキシコール酸が無効であればプレドニゾロンが著効する場合がある。その場合、最初はプレドニゾロン0.5 mg/kg/日以下で開始し、経過がよければ漸減し、最終的にはウルソデオキシコール酸などに可能な限り変更していく。幸い今回の症例ではウルソデオキシコール酸600 mg/日で治療開始し、ALPは徐々に低下し正常化した。
合併症としては、血液検査上のバイオマーカーで骨粗鬆症の治療を開始するべき基準を満たしていた。また、骨粗鬆症のほかにPBCに合併しやすい疾患として慢性甲状腺炎やシェーグレン症候群がある。血液検査では慢性甲状腺炎の合併はなさそうであった。一方シェーグレン症候群の場合、ドライアイ、ドライマウスの症状を訴え、今回の症例でも問診すると、以前から、唾液分泌が悪いという自覚症状はあったが、年齢に伴うものだろうと思っていたという。SS-A抗体 381.3 U/ml、SS-B抗体 2.7 U/mlとSS-A抗体が陽性であったので、ガムテストなどの検査をしていないので確定診断には至っていないが合併している可能性は十分あった。

