健診で血尿と蛋白尿
問題82
43歳の男性。健診での尿検査の悪化を指摘され精査を依頼され来院。
現病歴:以前より健診で高血圧(150/100 mmHg前後)や高脂血症も指摘されていた。2~3年前から検尿で尿蛋白1+を指摘されていた。今年は尿蛋白3+となり、高血圧もあるので産業医から近医受診を勧められた。検査の結果、Crが上昇しており、蛋白尿、尿潜血も出ているため当院紹介となった。肉眼的血尿はない。
現症:血圧170/105 mmHg、脈拍87/分、体温36.4℃、Spo2 98%。眼瞼結膜に貧血なし。心音・呼吸音に異常なし。腹部は平坦、軟。四肢に浮腫なし。
検査所見:尿所見:蛋白 1240 mg/dL、潜血(3+)、尿中Cr 448.6 mg/dL、沈査:赤血球16~30/視野(変形あり)、白血球5~7/視野、扁平上皮0~1/視野、硝子円柱0~1/視野。白血球5800/μL、Hb 14.4 g/dL、血小板28.3×104/μL。血液生化学所見:T-P 6.7 g/dL、Alb 4.2 g/dL、BUN 17 mg/dL、Cr 1.72 mg/dL、AST 21 U/L、ALT 20 U/L、Na 139 mEq/L、K 4.7 mEq/L、Cl 104 mEq/L。免疫血清学所見:ANA<×40、PR3-ANCA<1.0 U/mL、MPO-ANCA<1.0 U/mL、CH50 54.0 U/mL(基準30~50)。
腎生検組織を示す。

本疾患の腎機能に関する予後に関連する因子はどれか。2つ選べ。
(a)尿中赤血球
(b)尿中白血球
(c)尿蛋白
(d)Hb
(e)血清Cr
解説(オリジナルは『Dr. Tomの内科症例検討道場』にはないが院内で行った内科症例検討道場で症例324として扱ったもの)
今回のように、特に肉眼的血尿などの自覚症状もなく、健診で血尿や蛋白尿を指摘されており(チャンス血尿、チャンス蛋白尿と表現する)、しかも以前からも蛋白尿は指摘されていること、Cr 1.72 mg/dL、eGFR 36.4 mL/minと明らかに慢性腎臓病(Chronic kidney disease;CKD)を有していると疑われる症例である。顕微鏡的血尿がある場合、一般的には、赤血球に変形があれば腎炎の疑いなど腎臓内科的な疾患が多く、変形がなければ膀胱癌、腎癌、など泌尿器科的な疾患が多い。今回の症例でも尿中赤血球に変形がみられ、慢性腎炎症候群の中で鑑別を進めていくことになる。
簡易に画像的なスクリーニングを行うため超音波検査を行ったうえで腎生検が行われる。生検前には極端な腎萎縮がないかどうかなどチェックする。今回の症例でも腎生検が施行された。その組織をみると、ほとんどの糸球体でメサンギウム細胞の増生とメサンギウム基質の増加もみられ、メサンギウム領域の増殖性変化があると診断される(図1)。補体価の低下がなく、健診での受診がきっかけとなった経過などから、IgA腎症が最も考えやすい。あとは蛍光抗体法などでIgAやC3などのメサンギウム領域への沈着を証明し確定診断する。
予後に関連する因子については、後述するように臨床的な因子として蛋白尿、血清Cr、eGFR、組織学的な因子として半月体形成、全節性あるいは分節性硬化などがあげられる。
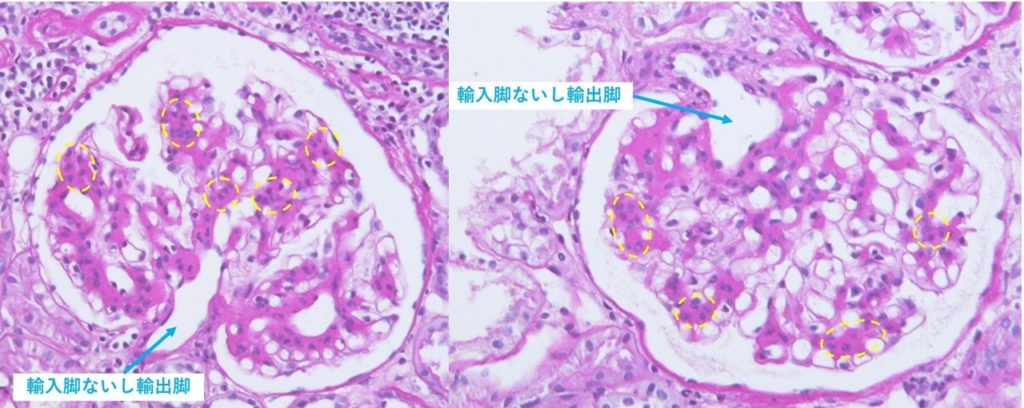
図1;腎生検組織像(HE染色)。メサンギウム領域の増殖性変化を認める(黄色破線内)。
解答 (c)(e)
実際の症例では
IgA腎症は、本邦の原発性糸球体腎炎の中で最も頻度が高い。今回の症例のようにチャンス血尿、チャンス蛋白尿など無症状で健診での指摘で精査にいたって診断されることが多い。持続的顕微鏡的血尿がみられ、しばしば変形赤血球、赤血球円柱なども認められる。蛋白尿は持続的あるいは間欠的にみられる。急性上気道炎や急性胃腸炎などの感冒時に肉眼的血尿が見られる場合もあり、これがみられれば本疾患である可能性が高い。IgA腎症という疾患名の通り、血清IgAが半数以上の症例で上昇しており、これがみられればIgA腎症を疑うが、逆に今回の症例のように正常であっても否定できるわけではない。補体の消費亢進による血清補体価の低下がみられる膜性増殖性糸球体腎炎、溶連菌感染後糸球体腎炎、ループ腎炎とは異なり、本疾患では血清補体価は正常である。腎生検ではメサンギウム領域にメサンギウム細胞の増生、メサンギウム基質の増加などの増殖性変化、その部位に蛍光抗体法でIgAの沈着が証明されれば診断は確定される。今回の症例ではIgAとC3のメサンギウム領域への沈着が認められた(図2)。このようにC3の沈着も証明される場合も多い。今回の患者の組織では半月体形成(図3)や分節性硬化や全節性硬化(図4)も認められ、これまでに著しい糸球体腎炎が生じていたことを示唆しており、予後不良所見と考えられた。

図2:蛍光抗体法。IgAとC3のメサンギウム領域への沈着が認められIgA腎症と診断された。
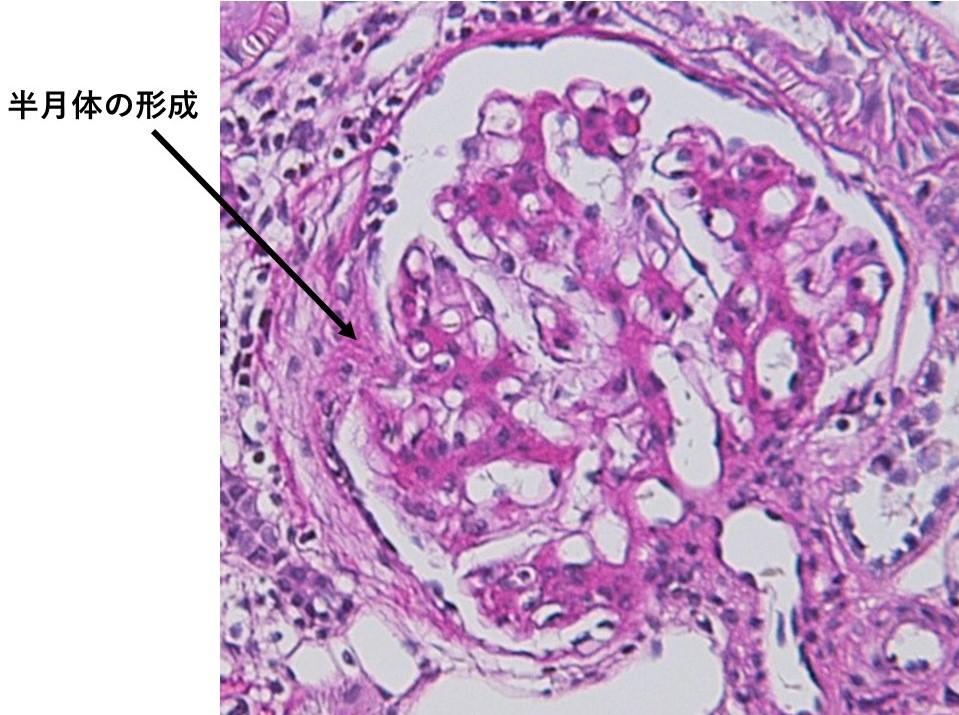
図3:腎生検組織像(HE染色)。半月体形成を認めるものもある。
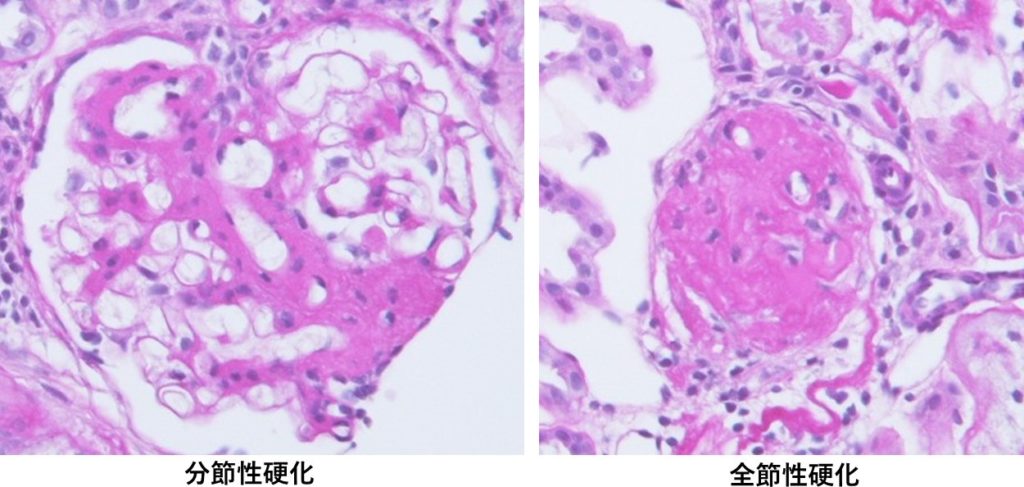
図4:腎生検組織像(HE染色)。分節性硬化や全節性硬化を認めるものもある。
以前は、本疾患は予後良好とされていたが、20年以上経過をみていくと、20~40%の症例で末期腎不全となって透析導入を要することが明らかとなった。このため、どのような症例が末期腎不全に移行していくかについて臨床研究が行われ、腎生検による組織学的重症度(H-Grade)と組織採取時の臨床データ(尿蛋白、eGFR)に基づく臨床的重症度(C-Grade)との組み合わせにより、末期腎不全への移行リスクが低リスク、中等リスク、高リスク、超高リスクに分類されている(表1)。具体的には、組織学的重症度は、全糸球体数の中の、全節性あるいは分節性糸球体硬化、細胞性あるいは線維細胞性半月体、線維性半月体などのある糸球体数の割合が25%未満をH-Grade Ⅰ、25%~49%をH-Grade Ⅱ、50%以上をH-Grade Ⅲ(50~74%)、Ⅳ(75%以上)とする。臨床的重症度は蛋白尿0.5 g未満/日をC-Grade Ⅰ、尿蛋白0.5 g/日以上かつeGFR≧60をC-Grade Ⅱ、尿蛋白0.5 g/日以上かつeGFR<60をC-Grade Ⅲとして、組織学的重症度と臨床的重症度との組み合わせによって表1のように透析導入リスクを層別化するものである。IgA腎症が進行する場合は、免疫学的活動性が高くて急性炎症性所見が進行する症例や、高血圧、高脂血症なども合併して糸球体硬化、細動脈硬化、間質線維化など硬化性病変が進行する症例など、さまざまである。
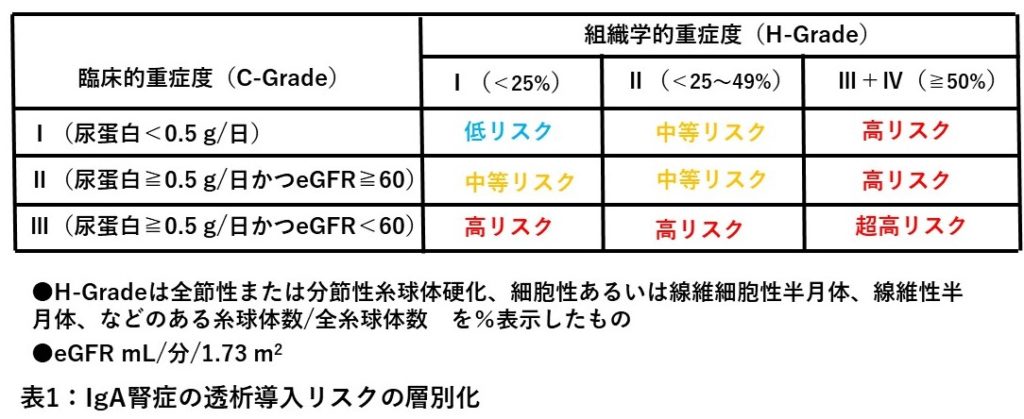
ここで全節性とは一個の糸球体当たり50%以上を占拠する病変、分節性とは50%未満の病変である。低リスクとは透析療法に移行するリスクが少ないもの、中等リスクは中程度リスクがあるもの、高リスクとは移行する可能性が高いもの、超高リスクとは5年以内に移行する可能性が高いもの、を指している。
今回の症例では、半月体形成、全節性あるいは分節性硬化の頻度は全糸球体を検討した結果、H-Ⅰとなり、C-Ⅲ、H-Ⅰで高リスク群に分類された。
治療は上記のリスク群ごと推奨される生活指導、食事指導(25~35 Kcal/kg標準体重/日)、薬物療法を行っていく。生活指導としては、どのリスク群でも共通して禁煙、適正体重への減量や維持、適正飲酒量などの指導を行う。高リスク群以上の症例には、塩分は6 g/日未満、タンパク質は0.6~0.8 g/kg標準体重/日の制限が推奨されている。薬物療法の適応と考えられる場合には、免疫学的機序への治療として重症度に応じて経口ステロイド内服、ステロイドパルス療法、扁桃摘出術+ステロイドパルス療法などが試みられる。扁桃摘出術は本邦では積極的に行われているが、海外のKDIGOのガイドラインではエビデンスの不十分さという理由で、現時点では施行しないことを推奨している。この原因として、欧米でのIgA腎症の発症には慢性炎症性腸疾患に伴う消化管由来のIgAの産生が関与していると考えられているのに対して、日本やアジア諸国では扁桃や咽頭から産生されるIgAが病因となっているためではないかと考えられ、今後、日本を含めたアジアから扁桃摘出術に関するエビデンスが蓄積されていくものと期待されている。抗血小板薬のうち、ジピリダモールやジラゼプは蛋白尿低下作用の報告があるが、腎機能障害の進展抑制作用は証明されていない。高血圧がある場合は降圧薬による血圧コントロールを行うが、特に軽度腎障害の症例にはレニン・アンギオテンシン系阻害薬が腎障害の進行を抑制すると言われ推奨されている。

