発熱と倦怠感から重症化
問題81
53歳、女性。発熱、悪心、倦怠感を主訴に来院した。
既往歴:高脂血症で近医通院中。
現病歴:4日前の夜に38℃代の発熱を認め、3日前に近医受診し抗生剤の処方を受けた。一旦解熱していたが、昨日未明より発熱が再燃し、悪心、倦怠感も出現。症状が再燃してからは普通便ながら排便回数が増えた。症状が続くため当院受診された。
現症:意識清明。身長 157.0 cm、体重 50.0 kg。血圧103/61 mmHg、脈拍113/分、体温38.7℃。貧血や黄疸を認めず。皮膚、可視粘膜に貧血、黄疸なし。肺野には呼吸音に異常を認めず。心音:整、病的雑音聴取せず。下腿に浮腫なし。
検査所見:血液所見:白血球6600/μL(好中球91.0%、リンパ球7.0%、単球2.0%)、赤血球 405×104/μL、Hb 11.7 g/dL、Hct 35.8%、血小板16.5万/μL。血液生化学検査:CRP 14.05 mg/dL、LDH 319 U/L、AST 95 U/L、ALT 50 U/L、ALP 218 U/L、CPK 620 U/L、BUN 16 mg/dL、Cr 0.68 mg/dL、Na 137 mEq/L、K 4.0 mEq/L、Cl 105 mEq/L、血糖 157 mg/dL。
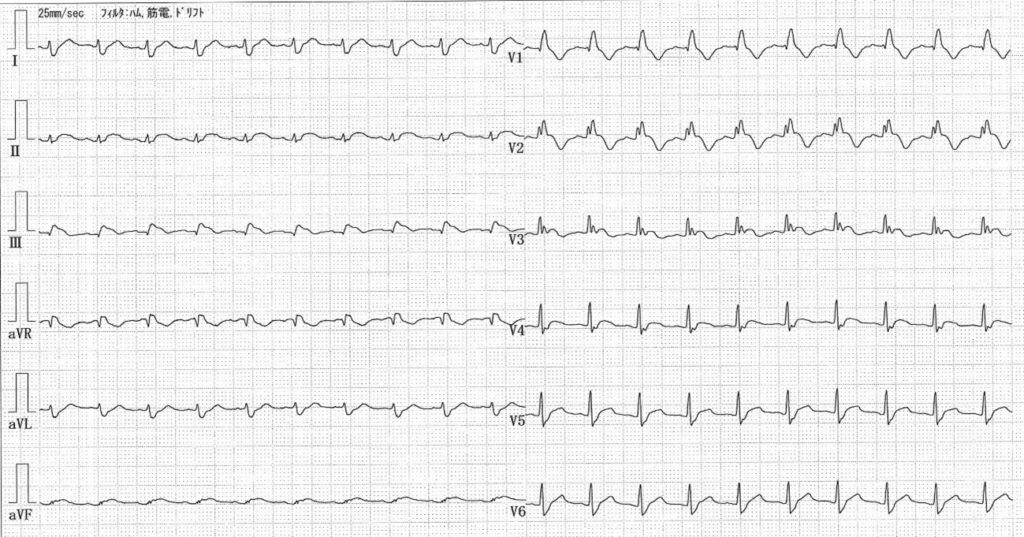
救急受診時の心電図を示す。
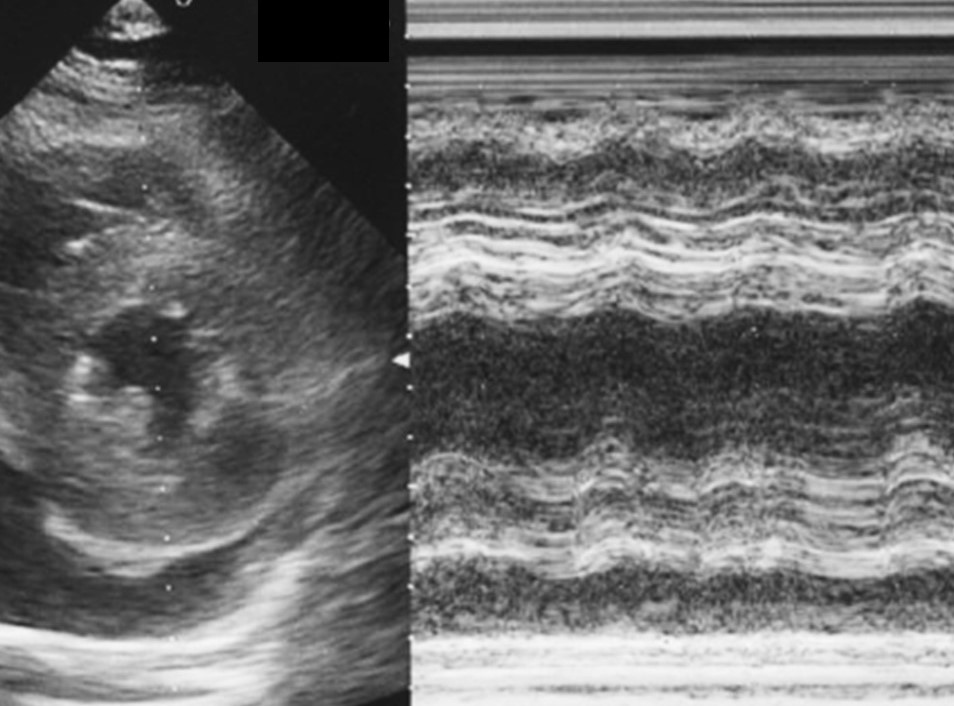
心エコー所見を示す。
考えられるのはどれか。1つ選べ。
(a)心サルコイドーシス
(b)急性心筋炎
(c)たこつぼ型心筋症
(d)肥大型心筋症
(e)急性心筋梗塞
解説(オリジナルは『Dr. Tomの内科症例検討道場』第4版にはないが院内で行った内科症例検討道場で症例232として扱ったもの)
発熱と悪心、下痢ではないが頻回の排便とのことで、問診の段階では急性胃腸炎のような病態と考えるのが普通である。ところが血液検査をみると炎症反応の上昇とCPK、AST、LDHなど筋原性酵素の上昇がみられる。そこで12誘導心電図をみると四肢誘導、胸部誘導ともに低電位がみられている。低電位は、肢誘導においてはⅠ、Ⅱ、Ⅲ、aVR、aVL、aVFすべてのQRS振幅≦0.5 mVで、胸部誘導においてはV1~V6すべてのQRS振幅≦1.0 mV、と定義される。肢誘導のみで低電位を示す場合は四肢の浮腫を示唆し、肢誘導・胸部誘導ともに低電位を示す場合は、心筋全体の起電力が低下したか、心臓周囲に胸水、心嚢液など何らかの不良伝導を招く要素(具体的には肥満、気胸、多量胸水・心嚢水)が存在することを示唆する。さらに大事なポイントとして、QRSのあとに続くST-Tの部分が、一部の誘導、少なくともⅡ、Ⅲ、aVFでは明らかに上昇している(図1)。そこで心エコーをみると、心嚢液が軽度貯留しており、心筋壁は著明に浮腫がみられ肥厚壁運動が著しく低下している像が得られた(図2)。発熱、炎症反応の上昇なども含めて総合的に考えると急性心筋炎と診断できる。それなら胃腸症状は何らかのウイルスによる先行感染と位置付けられるのではないかと考えることもできる。
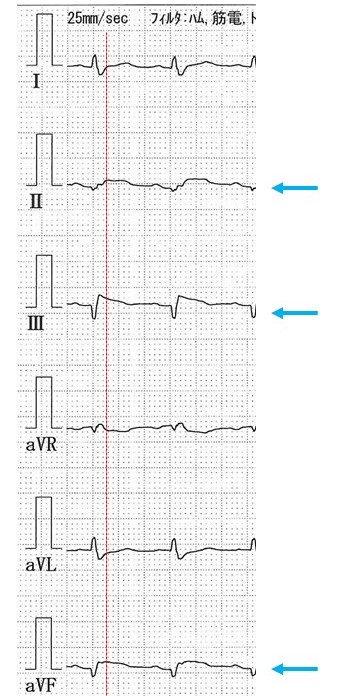
図1:救急受診時の心電図四肢誘導。赤線がQRSとST-T部分との境界であり、ここで基線より上昇しているものはSTの上昇と考えられる。少なくとも青矢印の肢誘導ではST上昇を認める。
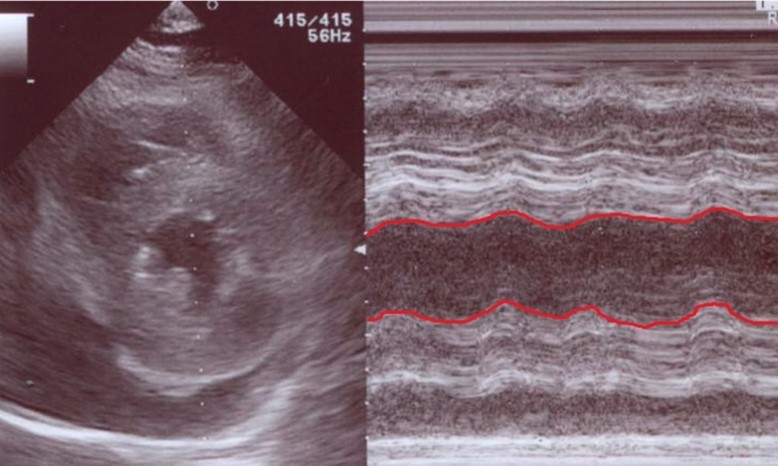
図2:緊急心エコー画像。心嚢液が軽度貯留しており、びまん性の壁運動の低下、心筋の浮腫像を認めた。Visual EF 20%程度であった。赤線の部分がほとんど平行線をたどっておりほとんど左室が動いていないことがわかる。
解答:(b)
実際の症例では
今回問題用に提示したデータは実は入院翌日のデータであり、救急受診時には、WBC 7600/μL、CRP 8.52 mg/dL、LDH 249 U/L、CPK 236 U/L程度であった。その後、この症例はカテコラミンによる治療にも反応が悪く、循環器内科に転科のうえ機械的補助循環装置による循環管理を行うため緊急大動脈バルーンパンピング(Intra-aortic balloon pumping;IABP)が導入された。急性心筋炎の中でも、このように発病初期に体外循環補助を要するような心肺危機に陥る劇症型心筋炎の経過であった。IABPとは、特殊なバルーンカテーテルを胸部下行大動脈に留置し、拡張期に体外駆動装置から急激にヘリウムガスを充填(インフレートinflate)し、収縮期にはこれを急速に脱気(デフレートdeflate)する。拡張期にバルーンを急激にふくらませることによって、バルーン前方に逆行性の大動脈血流を増加させ、脳血流や冠動脈血流を増やす。これは心拍出のない拡張期にバルーン上方の大動脈に逆行性の血流を生み出すカウンターパルセーションである(このため大動脈弁閉鎖不全による心不全の症例には禁忌となっている)。一方、収縮期には急激にバルーンを脱気することによってその吸引効果により後負荷がとれ、より弱い心臓の力でも多くの血液を拍出できる(図3)。
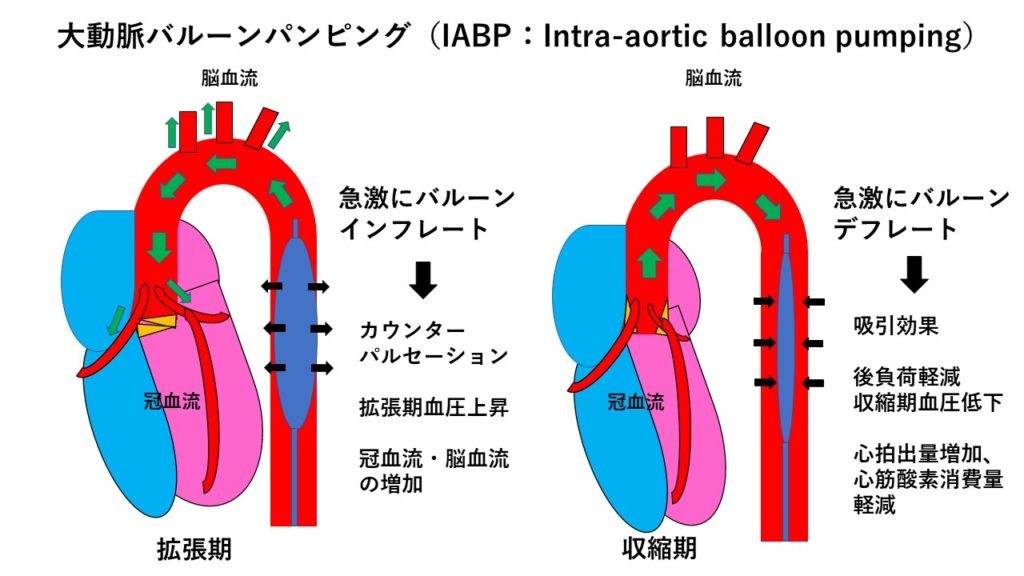
図3:大動脈バルーンパンピング(IABP)の原理。IABP用バルーンカテーテルを胸部下行大動脈に留置し、拡張期に体外駆動装置から急激にヘリウムガスを充填(インフレートinflate)し、収縮期にはこれを急速に脱気(デフレートdeflate)する。拡張期にバルーンを急激にふくらませることによって、バルーン前方に逆行性の大動脈血流を増加させ、脳血流や冠動脈血流を増やす(カウンターパルセーション)。一方、収縮期には急激にバルーンを脱 気することによってその吸引効果により後負荷がとれ、より弱い心臓の力でも多くの血液を拍出できる
一旦収縮期圧は100 mmHg程度まで回復し、意識も戻り笑顔もみられていた。しかし翌日朝には心エコー上もやはりVisual EF 20%程度と変わらず、経皮的心肺補助装置(percutaneous cardiopulmonary support;PCPS)を導入する方針でインフォームドコンセントを得た。しかしその矢先にVTが生じ、CPRを行いながら血管造影室へと患者を搬送し、最終的にPCPSが装着できた。PCPSの原理を下に示す(図4)。当院循環器内科医のすばらしい専門的治療により、その後は、心臓移植の目的でさらに高次の医療機関へと転院された。
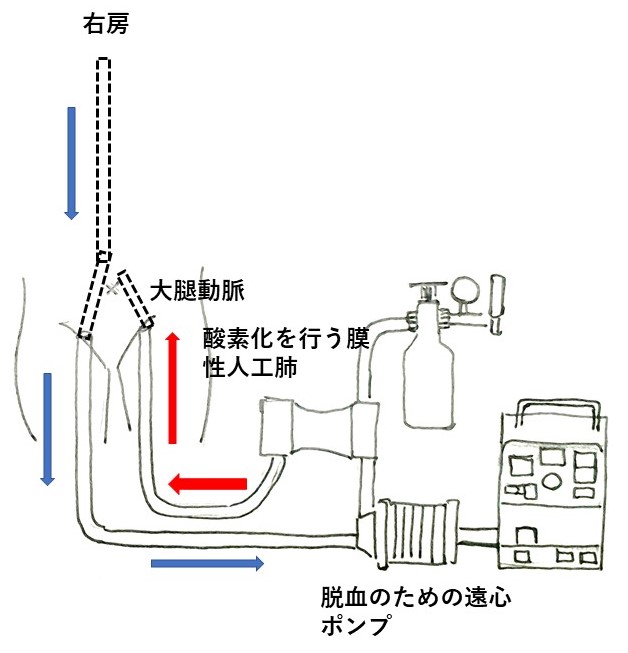
図4:経皮的心肺補助装置(percutaneous cardiopulmonary support;PCPS)の原理。右房に挿入された静脈カテーテルから遠心ポンプの力で静脈血を脱血し、膜型人工肺で酸素化し、これを動脈カニューレから送血する。
PCPSの適応としては、①心筋梗塞や心筋炎で、IABP施行下でも心係数が1.5 L/min/m2以下の重症ポンプ失調例、②難治性で繰り返す心室細動や心室頻拍患者、③急性冠症候群の冠動脈形成術までのサポートやつなぎ、④急性肺血栓塞栓症によるショック、⑤偶発性低体温による循環不全、⑥心肺停止蘇生例など、が挙げられている。

